朱棣,中科院上海生化细胞所博士毕业,哈佛大学博士后,现任复旦大学药学院研究员、博士研究生导师;上海浦东复旦大学张江科技研究院研究员;2016年入选国家青年“*人计划”,2015年受聘为哈佛大学医学院医学讲师(Instructor/faculty)。现任中国药理学学会化药专业委员会委员、中国博士后科学基金会评委、中国老年学和老年医学学会肿瘤分会专家委员会专委、美国AACR和ASCO会员。
主要研究领域、方向:1.肿瘤免疫药理学机制研究;2.肿瘤靶向治疗新药开发。
致力于转化医学和药物早期发现的研究,在靶点验证和新药早期研发领域中积累多年经验。完成了第一个癌症特异性的多肽类Wnt信号通路抑制剂的研究和发现,开发出了针对BCL9/β-catenin的First-in-class抑制剂;建立了第一个以骨髓内皮细胞为基质的骨髓转移体内动物模型的建立,发现了CyPA-CD147信号通路介导的骨髓微环境的肿瘤细胞转移的机制研究,提供了一种多发性骨髓瘤潜在的新的治疗靶点,填补了多发性骨髓瘤中转移机制研究空白,鉴定出了新的潜在的诊断靶点Cyclophilin A,为临床阶段新药CD147单抗提供了在多发性骨髓瘤中的潜在的新的适应症,为多发性骨髓瘤提供了潜在的新的治疗方法。
教育经历
2001.09—2005.07 山东大学生物化学与分子生物学专业本科生
2005.09—2010.07 中国科学院研究生院生物化学与分子生物学专业博士研究生
工作经历
2011.01—2015.06 美国哈佛大学Dana-Farber 癌症研究所博士后
2015.07—2016.05 美国哈佛大学Dana-Farber 癌症研究所讲师(junior faculty)
2016.10— 2021.07 复旦大学药学院,博士生导师
2017.01— 至今 复旦大学附属闵行医院兼职教授
2021.08— 至今 复旦大学基础医学院,博士生导师
学术兼职
2017-今 中国药理学会 会员
2018-今 上海市药理学会 会员
2019-今 中国老年学和老年医学学会老年肿瘤分会专家委员会 专业委员
2021-今 中国药理学会化药专业委员会 专业委员
2022-今 中国抗癌协会 会员
主讲课程:
本科生课程:
药理学、口腔临床药物学、药学分子生物学、生物化学
研究生课程:
高级药理学进展、高级临床药理学、高级神经药理学、药学进展
博士后招聘:
复旦大学基础医学院药理学系朱棣组招聘博士后
复旦大学基础医学院药理系朱棣组现面向国内外招聘具有肿瘤药理学、 肿瘤细胞生物学、免疫学背景的博士后。
实验室主要针对肿瘤免疫微环境的Wnt信号通路,从分子水平、细胞水平、动物模型及临床样本上系统地研究肿瘤免疫反应中的信号作用机制,方向主要为转化医学和早期药物发现的研究,更侧重于利用单细胞测序技术研究肿瘤微环境中免疫细胞,肿瘤细胞作用的主要机制,以及新靶标药物筛选和其作用机制研究,期望鉴定出可用于药物筛选的分子靶标或可用于临床的先导化合物,并提出免疫诊断及治疗的新途径。
课题组长朱棣教授主要从事肿瘤免疫药理学机制以及肿瘤靶向治疗新药开发分子机制研究,现为复旦大学基础医学院博士生导师,复旦大学附属闵行医院兼职教授。其研究成果以第一或通讯作者发表在Nature Medicine,Cancer Discovery, Signal Transduction and Targeted Therapy, Science Translational Medicine , Science Advances, Oncogene,British Journal of Pharmacology,Pharmacological Research等杂志,总共发表SCI论文24篇,单篇最高影响因子53。 并获得“国家青年特聘专家”、“ 复旦卓识人才”等称号。主持项目11项,参与4项。申请国际专利4项,授权2项;国内专利6项。2项科研成果已经进入非注册临床试验。受邀在2017年美国AACR年会分论坛做大会报告。兼职中国药理学会化药专业委员会,专业委员;中国老年学和老年医学学会肿瘤分会,专业委员。担任Nature communications等杂志审稿人. 曾任欧洲SCI杂志Contemporary Oncology副主编。实验室目前有充足的经费,非常有前景的课题和成熟的实验资源,诚聘具有生物学、免疫学、药理学背景的博士后。
1.应聘者应具备的条件如下
(1)已获得或即将获得国内外知名大学的博士学位;
(2)有志从事科学研究,具有强烈的科研兴趣,有意从事肿瘤免疫药理学研究;
(3)具有积极向上的工作热情,优秀的学习能力,良好的学术道德和团队合作精神。能独立开展科研工作;
(4)获得生物学或医学领域博士学位,有分子生物学、细胞生物学和免疫相关研究经历者优先考虑;
(5)在国际主流学术期刊上发表过第一作者论文(IF大于5)。
2.岗位待遇:
(1)提供有竞争力的薪酬待遇,年薪20-30万元左右;课题组优先鼓励申请人社部博新计划、上海市超博、复旦大学超博等(具体参考: https://mp.weixin.qq.com/s/hurbGXoXfvPPpgkjLal4Ww),超级博士后年薪28-40万;
(2)学校提供人才公寓,保障全职博士后的住房需求;
(3)博士后期间,发表高水平SCI论文可享受课题组奖励政策;
(4)为全职博士后提供医疗保险、体检服务等保障;
(5)充分发挥复旦大学优质基础教育资源,积极保障全职博士后子女入学;
(6)博后期间表现优异者,可优先机会留在复旦大学工作(有编制);
(7)特别优秀者在待遇方面还可进一步商榷。
3.应聘材料递送
请应聘者将个人简历(包括学习工作经历、主要研究工作内容、发表论文、奖励情况、个人近照等)、学历学位证书复印件、1-2封推荐信及推荐人的联系方式(可在初审通过后提供),发送至:zhudi@fudan.edu.cn。E-mail标题请注明"应聘博士后岗位+姓名"。对符合要求者将尽快安排面试。
应聘材料单位将予以保密。此招聘信息长期有效。
研究方向
1、靶向BCL9/β-catenin的药理学机制研究。
2、肿瘤免疫治疗新药开发。
科研项目
1、2018,上海市科委科研计划项目,“Wnt信号通路调控的肿瘤免疫微环境在结肠癌免疫抵抗的研究”,主持。
2、2018,上海市科委科研计划项目,“结肠癌靶向EPCAM1通用型CART细胞治疗研究”,参与。
3、2018,复旦大学自主研究课题融合基金,“Fzd4在肿瘤干细胞中的研究和新抑制剂开发”,主持。
4、2019,国家自然科学基金面上项目,“用于癌症免疫治疗新型RORγt激动剂的设计合成与作用机制研究”,参与。
5、2019,国家自然科学基金面上项目,“Wnt信号通路抑制剂调控肿瘤免疫微环境的机制研究”,主持。
6、2019,上海市科委生物医药领域科技支撑项目,“新型癌症免疫治疗药物RORγt激动剂YWRQ-16的临床前研究”,参与。
7、2019,复旦大学-中国科学院上海药物研究所融合基金项目,“基于单细胞测序技术的肝癌细胞图谱解析及新型生物标记物的发现和鉴定”,主持。
8、2019,复旦大学“卓越2025”人才培育计划卓识计划,主持。
9、2020,上海市科委“科技创新行动计划”国际合作项目,“新型亲环素抑制剂抗新型冠状病毒的研究”,主持。
10、2021,复旦大学先导项目,结肠癌免疫治疗关键技术研究,主持。
11、2021,国家自然科学基金面上项目,“BCL9/9L调节T细胞的肿瘤浸润改善PD-1治疗耐药的研究”,主持。
代表性专利:
[1]靶向EpCAM抗原的CAR-NK细胞及其制备与应用, 2022-2-28, 中国, 202210187618.8。
[2]Zhu Di;Stabilized BCL9 Peptides for Treatment of Aberrant Wnt Signaling,2017/04/13,US,WO2017/062518 A1
[3]Zhu DI; Carrasco Ruben; Compositions and Methods for Treating Malignancies, 2016/04/7, US,WO2016/054354 A1
发明公开:
[1]樊嘉, 朱棣, 杨欣荣, 胡博, 吴随一, 朱远远, 孙嘉磊, 周俭. 靶向BCL9/β-catenin复合体的先导肽[P]. 上海市: CN117801074A, 2024-04-02.
[2]赵玉军, 朱棣, 周飞龙, 严子琴, 刘成龙, 曾子余, 程颖. 具有苄氧基芳基醚结构的化合物及其制备方法和用途[P]. 上海市: CN117177969A, 2023-12-05.
[3]赵玉军, 朱棣, 周飞龙, 严子琴, 刘成龙, 曾子余, 程颖. 具有苄氧基芳基醚结构的化合物及其制备方法和用途[P]. 上海市: CN116768870A, 2023-09-19.
[4]李建其, 朱棣, 张庆伟, 刘成龙, 张浩, 沈栎安, 王冠. β-catenin/BCL9蛋白蛋白相互作用的小分子抑制剂及其应用[P]. 上海市: CN116444420A, 2023-07-18.
[5]李建其, 朱棣, 张庆伟, 刘成龙, 张浩, 沈栎安, 王冠. β-catenin/BCL9蛋白-蛋白相互作用的小分子抑制剂及其应用[P]. 上海市: CN116162056A, 2023-05-26.
[6]樊嘉, 徐泱, 朱棣, 胡博, 喻敏成, 孙嘉磊, 马晓路, 吴随一, 周俭. 一种癌症免疫治疗疗效和预后预测试剂盒[P]. 上海市: CN115575620A, 2023-01-06.
[7]朱棣, 王永辉, 谢琼, 田恩铭, 夏莉, 郁明诚. 一种RORγ激动剂及其在制备治疗肿瘤疾病药物以及促进Type17细胞分化中的应用[P]. 上海市: CN115521233A, 2022-12-27.
[8]朱棣, 余科, 吴重恩. 一种CAR-T治疗载体及其构建方法和应用[P]. 上海市: CN115125272A, 2022-09-30.
[9]樊嘉, 徐泱, 朱棣, 胡博, 喻敏成, 孙嘉磊, 马晓路, 吴随一, 周俭. 抗PD-1抗体与IFN-α联合在制备抗肿瘤药物中的用途[P]. 上海市: CN114917335A, 2022-08-19.
[10]徐宇秋, 许剑民, 汤文涛, 吕洋, 吉美玲, 朱棣. 基于活化B细胞表达的结肠癌预后诊断用标记物及其用途[P]. 上海市: CN114019163A, 2022-02-08.
[11]徐宇秋, 许剑民, 汤文涛, 吕洋, 吉美玲, 朱棣. 基于B细胞表达的结肠癌预后诊断用标记物及其用途[P]. 上海市: CN113834941A, 2021-12-24.
[12]朱棣. EpCAM-CAR-T和hsBCL9-(CT)-24的组合物在制备抗肿瘤药物中的应用[P]. 上海市: CN112516298A, 2021-03-19.
[13]朱棣, 陆伟, 陆路, 刘成龙, 魏国光, 徐巍, 夏帅. CsA脂质体在制备抗SARS-CoV-2药物中的应用[P]. 上海市: CN112472791A, 2021-03-12.
[14]朱棣, 冯梅. 一种抗肿瘤的多肽及其应用[P]. 上海市: CN110003312A, 2019-07-12.
发明授权:
[1]朱棣, 王永辉, 谢琼, 田恩铭, 夏莉, 郁明诚. 一种RORγ激动剂及其在制备治疗肿瘤疾病药物以及促进Type17细胞分化中的应用[P]. 上海市: CN115521233B, 2024-02-09.
[2]徐宇秋, 许剑民, 汤文涛, 吕洋, 吉美玲, 朱棣. 基于B细胞表达的结肠癌预后诊断用标记物及其用途[P]. 上海市: CN113834941B, 2024-01-05.
[3]朱棣. 一种靶向EpCAM-CART细胞与hsBCL9CT-24的组合在抗肿瘤中的应用[P]. 上海市: CN112516298B, 2022-11-01.
[4]赵玉军, 朱棣, 周飞龙, 严子琴, 刘成龙, 张希晨. 一种具有苄氧基芳环结构的化合物,其制备方法和用途[P]. 上海市: CN112028870B, 2021-11-05.
代表性论著:
1.Hu, B., Yu, M., Ma, X., Sun, J., Liu, C., Wang, C., Wu, S., Fu, P., Yang, Z., He, Y., Zhu, Y., Huang, C., Yang, X., Shi, Y., Qiu, S., Sun, H., Zhu, A., Zhou, J., Xu, Y., Zhu, D.*, Fan, J.* Interferon-α potentiates anti-PD-1 efficacy by remodeling glucose metabolism in the hepatocellular carcinoma microenvironment. Cancer Discov., 2022. DOI: 10.1158/2159-8290.CD-21-1022 (IF: 39.4)
2.Xia, L., Tian, E., Yu, M., Liu, C., Shen, L., Huang, Y., Wu, Z., Tian, J., Yu, K., Wang, Y., Xie, D., Zhu, D.* RORγt agonist enhances anti-PD-1 therapy by promoting monocyte-derived dendritic cells through CXCL10 in cancers. J Exp Clin Canc Res. 2022. DOI : 10.1186/s13046-022-02289-2 (IF: 11.1)
3.Feng, M., Wu, Z., Zhou, Y., Wei, Z., Tian, E., Mei, S., Zhu, Y., Liu, C., He, F., Li, H., Xie, C., Jin, J., Dong, J., Yang, D., Yu, K., Qian, J., Lambrechts, D.*, Wang, M.*, Zhu, D.* BCL9 regulates CD226 and CD96 checkpoints in CD8+ T c ells to improve PD-1 response in cancer. Signal Transduct Target Ther, 2021, 6, 313. (5 year IF: 22.1)
4.Wang, X., Feng, M., Xiao, T., Guo, B., Liu, D., Liu, C., Pei, J., Liu, Q., Xiao, Y., Rosin-Arbesfeld, R., Shi, Y., Zhou, Y., Yang, M., Feng, Y., Jiang, Y., Shao, Z., Yu, K.*, Zhu, D.* BCL9/BCL9L promotes tumorigenicity through immune-dependent and independent mechanisms in triple negative breast cancer. Oncogene, 2021, 40: 2982- 2997. (IF: 9.8)
5.Liu, C., Zhou, F., Yan, Z., Shen, L., Zhang, X., He, F., Wang, H., Lu, X., Yu, K., Zhao, Y.*, Zhu, D.* Discovery of a novel, potent, and selective small-molecu le inhibitor of PD-1/PD-L1 interaction with robust in vivo anti-tumor efficacy. Br. J. Pharmacol., 2021, 178(13): 2651-2670. (IF: 8.7)
6.Tian, E., Yu, M., Feng, M., Wang, Y., Xie, Q.*, Zhu, D.* RORγt agonist synergizes with CTLA-4 antibody to inhibit tumor growth through inhibition of Treg cells via TGF-β signaling in cancer. Pharmacol.Res., 2021, 172:105793. (IF: 7. 6)
7.Feng, M., Zhao, Z., Yang, M., Ji, J., Zhu, D.*, T-cell-based immunotherapy in colorectal cancer. Cancer Lett., 2021, 498(40): 201-209. (IF., 8.6)
8.Yunbin Zhang; Jingjing Song; Zhongwei Zhao; Mengxuan Yang; Ming Chen; Chenglong Liu; Jiansong Ji; Di Zhu*. Single-cell transcriptome analysis reveals tumor immune microenvironment heterogenicity and granulocytes enrichment in colorectal cancer liver metastases, Cancer Letters, 2020, 470: 84-94.
9.Zhang Y, Zhang N, Chen M, Zhu D*. Targeting tumor immune microenvironment for cancer therapy in human gastrointestinal intestine malignancies. Cancer Letter. 458:123-135 (2019). DOI:10.1016/j.canlet.2019.05.017.
10.Feng, M., Jin, J., Xia, L., Xiao, T., Mei, S., Wang, X., Huang, X., Chen, J., Liu, M., Chen, C., Raf, S., Zhu, A., Feng, Y.*, Zhu, D.* Pharmacolo gical inhibition of β-catenin/BCL9 interaction overcomes resistance to immune checkpoint blockad es by modulating Treg cells. Science Advances., 2019, 5(5): 1-16. (IF: 14.1)DOI: 10.1126/sciadv. aau5240.
11.Zhu, D., Wang, Z., Zhao, J., Calimeri, T., Meng, J., Hideshima, T., Fulciniti, M., Kang, Y., Ficarro, S., Tai, Y., Hunter, Z., McMilin, D., Tong, H., Mitsiades, C., Wu, C., Treon, S., Dorfman, D., Pinkus, G., Munshi, N., Tassone, P., Marto, J., Anderson, K., Carrasco, R.* The Cyclophilin A–CD147 complex promotes the proliferation and homing of multiple myeloma cells. Nat Med., 2015, 21(6): 572-580. (IF: 53.4)
12.Takada, K.#, Zhu, D.#, Bird, GH. #, Sukhdeol, K., Zhao, J., Mani, M., Lemieux, M., Carrasco, D., Ryan, J., Horst, D., Fulciniti, M., Mushi, NC., Xu, W., Kung, AL., Shivdasani, R., Walensky, L.*, Carrasco, R.* Targeted Disruption of the BCL9/β-Catenin Complex Inhibits Oncogenic Wnt Signaling. Sci Transl Med., 2012, 4(148): 1-13. (IF: 17.9 )
获得奖项
1、2024年 复旦大学优秀博士学位论文指导导师。
2、2024年 第三十五届上海市优秀发明选拔赛优秀发明铜奖。
3、2023年 中国抗癌协会科技奖二等奖。
4、2022年 上海生物工程学会“东富龙”生物工程优秀青年科学家奖。
5、2019年 增爱·长木学术奖,增爱中国基金会。
6、2014 年,科技部教育部“春晖杯”创业大赛纽约赛区三等奖。
7、2013年,北美高层次人才创新大赛全美第六名。
8、2012年,创业世界杯波士顿地区第二名中国创新创业大赛全国百强。
9、2011年,MIT VS Harvard商业案例比赛决赛Finalist。
10、2010年,欧洲生物化学与分子生物学联盟FEBS YTF Fellowship。
朱棣课题组

1. 课题组研究方向
课题组研究方向为靶向BCL9/β-catenin的药理机制和肿瘤免疫新疗法开发。具体方向为BCL9对免疫细胞的调控、BCL9对肿瘤微环境的调节以及促进免疫响应的新疗法的开发。
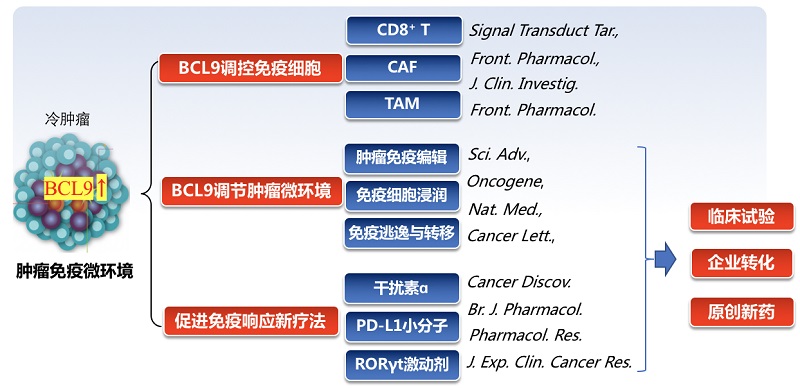
2. 课题组主要研究成果
代表性论文
代表性成果1:发现干扰素α增强肝癌PD-1抗体免疫疗法的药效并揭示药理学作用机制
Hu, B et al. Cancer Discov 2022, DOI: .org/10.1158/2159-8290.CD-21-1022
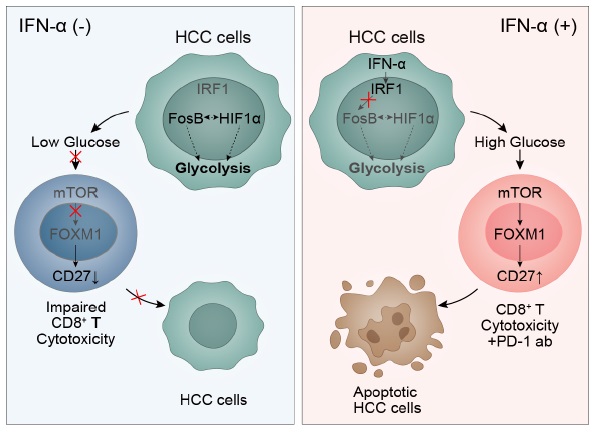
干扰素和抗PD-1抗体的组合导致了肿瘤微环境的重新编程,导致肿瘤中积累了高葡萄糖。这导致具有高代谢活性的 T 细胞亚型增加,可以更好地杀死肿瘤细胞。因为 T 细胞肿瘤杀伤活性的提高,这种联合免疫疗法治疗将有更好的成功机会。
代表性成果2:发现BCL9改善癌症中的PD-1反应的潜在机理
Feng, et al. Signal Transduct Target Ther. 2021;6(1):313.
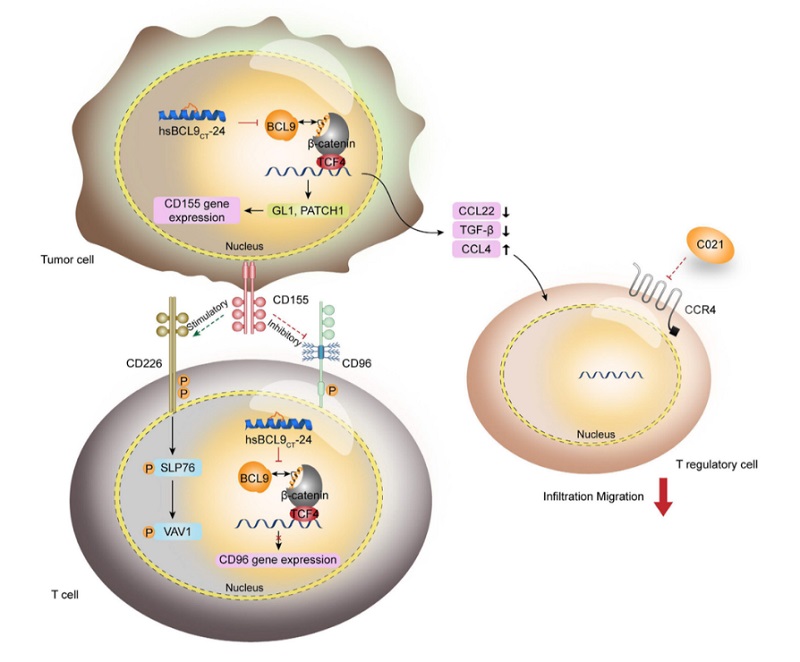
揭示了抑制BCL9能够调节CD8+ T细胞的CD226和CD96免疫检查点的平衡从而改善结肠癌患者对PD-1抗体的新分子机制。为结肠癌免疫治疗新靶标提供理论基础,为结肠癌免疫治疗提供新的思路。
代表性成果3:发现靶向BCL9 /β-catenin促进 PD-1 抗体响应
Feng, et al. Signal Transduct Target Ther. 2021;6(1):313.
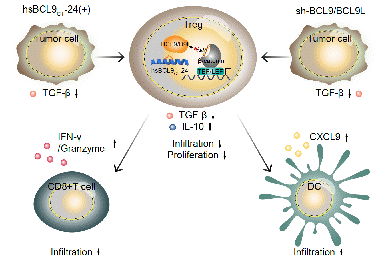
揭示了抑制BCL9能够调节CD8+ T细胞的CD226和CD96免疫检查点的平衡从而改善结肠癌患者对PD-1抗体的新分子机制。为结肠癌免疫治疗新靶标提供理论基础,为结肠癌免疫治疗提供新的思路。
3.近年来获批的重点项目或国家级人才项目
(1)国家自然科学基金面上项目,82073881,BCL9/9L调节T细胞的肿瘤浸润改善PD-1治疗耐药的研究,2021-01至2024-12,55万元,在研,主持。
(2)上海市科委科研国际合作项目,新型亲环素抑制剂的抗COVID-19新药开发,2020-10至2023-09,在研,50万,主持。
(3)国家自然科学基金面上项目,81872895,Wnt信号通路抑制剂调控肿瘤免疫微环境的机制研究,2019-01至2022-12,57万元,在研,主持。
(4)上海市科委科研计划项目,18ZR1403900,Wnt信号通路调控的肿瘤免疫微环境在结肠癌免疫抵抗的研究,2018-06至2021-05,20万元,完结,主持。
(5)中组部国家青年特聘人才项目,药理学,癌症新靶点的发现,2016-2019,完结,主持。
4.主要学术贡献
对于晚期结肠癌患者而言,缺乏有效治疗手段。免疫治疗是癌症治疗的革命性疗法,其中 PD-1抗体的治疗响应依赖于T细胞的浸润。90%的结直肠癌中存在Wnt/β-catenin通路的异常激活,并且和免疫抵抗的“冷肿瘤”相关。Wnt信号通路小分子抑制剂在肿瘤治疗领域的研究前景十分广阔,但是开发β-catenin抑制剂的其他挑战。
BCL9/β-catenin是Wnt信号通路的创新靶点,主要学术贡献包括:
(1)在成药性靶点验证方向,靶向BCL9和β-catenin的结合抑制癌症特异性Wnt信号通路,具有良好的安全窗口,通过靶向BCL9与β-catenin的结合可以潜在解决Wnt通路抑制剂成药性的挑战(Sci Transl Med.,2012)。
(2)在改善免疫耐药方向, 发现了靶向阻断BCL9和β-catenin结合,在结肠癌肿瘤中降低Treg的肿瘤浸润,改善肿瘤微环境中有利于免疫反应的发生,促进PD-1抗体响应(Sci Adv.,2019);进一步研究发现抑制BCL9能够调控CD226和CD96在CD8+ T细胞中的平衡,增强肿瘤免疫反应(Signal Transduct Target Ther,2021)。
(3)在肿瘤免疫微环境调控方向,发现BCL9调控肿瘤免疫微环境的多种细胞因子,促进肿瘤细胞的归巢,和促进免疫抑制性细胞的肿瘤浸润(Nat Med.,2015;Oncogene, 2021)。
5.课题组成员及成果情况概况
课题组目前在读博士研究生5名,硕士研究生4,联合培养博士后1。

成果情况如下:
基于前期工作Nature Medicine和Science Translational Medicine为基础,课题组近5年围绕“靶向BCL9如何调控的肿瘤免疫微环境和如何促进肿瘤免疫响应”的科学问题,复旦大学通讯作者文章在国际著名期刊Cancer Discovery, Signal Transduction and Targeted Therapy,Science Advances, Oncogene, British Journal of Pharmacology, Pharmacological Research等,单篇最高影响因子39.4
申请专利10项,2项专利两项完成授权,2项专利已在企业实现转化;研究成果中其中开发的2个药物分子进入临床前实验,2项研究成果进入非注册临床试验阶段。目前主持各类基金11项,获得奖项2项。指导学生11名,已经完成毕业3名,获得国家奖学金2项等其它8项奖项。
研究成果被Nature Reviews Clinical Oncology、Nature Reviews Cancer等国际专业学术媒体报道,同时被知名国内媒体如文汇报,新民网,科学网,澎湃新闻,学术经纬等专题报道。
6.国际合作情况
(1)在上海市科委科研国际合作项目中,与德国慕尼黑大学的Albrecht教授合作开展“新型亲环素抑制剂的抗新冠新药开发”,研究成果已发表。
(2)与Tel Aviv University大学Rina教授开展Wnt信号通路相关的免疫学研究合作,研究成果目前已发表在Oncogene和Frontiers in Pharmacology杂志。
7.科普短文
如何突破复杂肿瘤免疫微环境改变“冷肿瘤”成“热肿瘤”?
每年结肠癌病人有180万人,结肠癌是我国死亡率居于第四位的癌症,缺乏有效靶向治疗手段。80%以上的病人存在一个关键的信号通路—Wnt通路的突变,但是目前尚未有靶向Wnt通路的药物上市。免疫治疗是抗肿瘤革命性疗法,仅15%结肠癌的病人有效,肿瘤免疫微环境介导免疫耐药相关,缺乏有效治疗手段。
肿瘤细胞通过激活MAPK、WNT等信号通路获得免疫耐受。免疫微环境分子分型及免疫治疗耐药机制不断有新的发现,开发新型免疫细胞在肿瘤治疗中的新技术不断出现。 因此,研发出具有突破复杂肿瘤免疫微环境治疗的结肠癌药物,改善人民健康和提高患者生存率有着重要意义,同时对于突破国外药物专利限制,解决关键时刻不被“卡脖子”,具有重要的作用。
8.实验技术平台
(1)Wnt抑制剂药物筛选模型-用于筛选靶向BCL9/β-catenin抑制剂
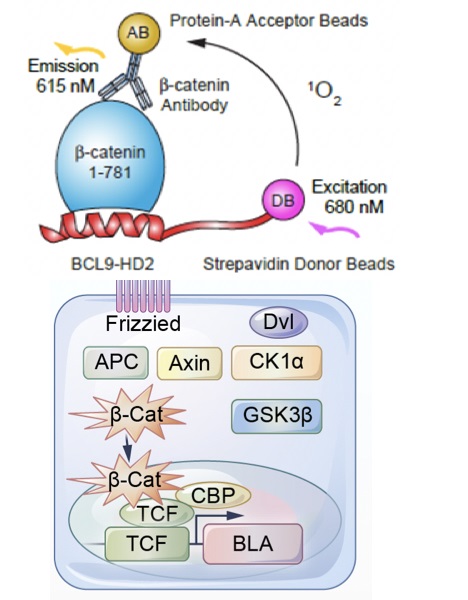
在稳定表达LEF / TCF报告基因的HCT116细胞,检测Wnt/β-catenin信号传导的抑制效果。然后,选择性细胞模型检测细胞增殖及Wnt下游信号分子的影响,其中Colo320DM是β-catenin生长依赖型的结肠癌细胞系,RKO是非依赖型的结肠癌细胞。
(2)CFSE靶细胞杀伤筛选模型-用于筛选促进T细胞杀伤活力的分子
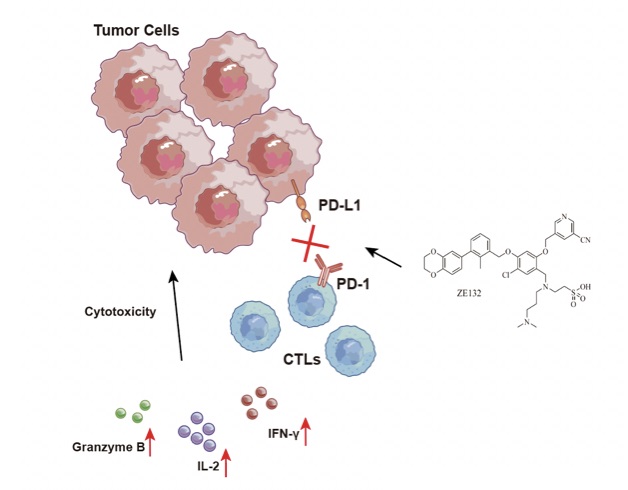
收集OT-I小鼠脾脏细胞,体外用OVA多肽刺激分化形成CD8+T细胞。用OVA多肽黏附靶细胞EL4,按照不同效/靶比将不同CD8+T细胞与CFSE标记的EL4细胞混合。将相等数量的CFSE标记的EL4细胞和EL4-OVA细胞混合均匀。效应细胞与靶细胞共培养。孵育后,流式上机检测。
(3)Type17 细胞体外分化模型-用于筛选促进Type17分化的活性分子
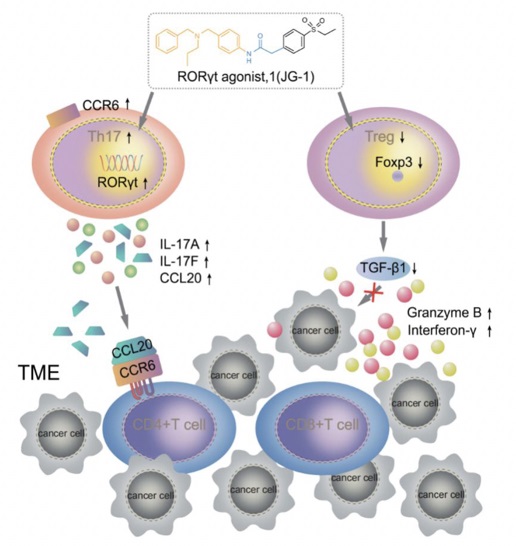
将Anti-CD3和Anti-CD28 进行48孔板包被。从小鼠中获得淋巴细胞悬液。根据EasySep™ Mouse Naïve CD4+T Cell Isolation Kit,收集Naïve CD4+T细胞。利用细胞因子进行分化,Anti-IL-4, Anti-IFN-gamma,IL-6,TGF-β,培养体系重悬分选获得的T细胞,每孔铺入包被有CD3/CD28的48孔板中。